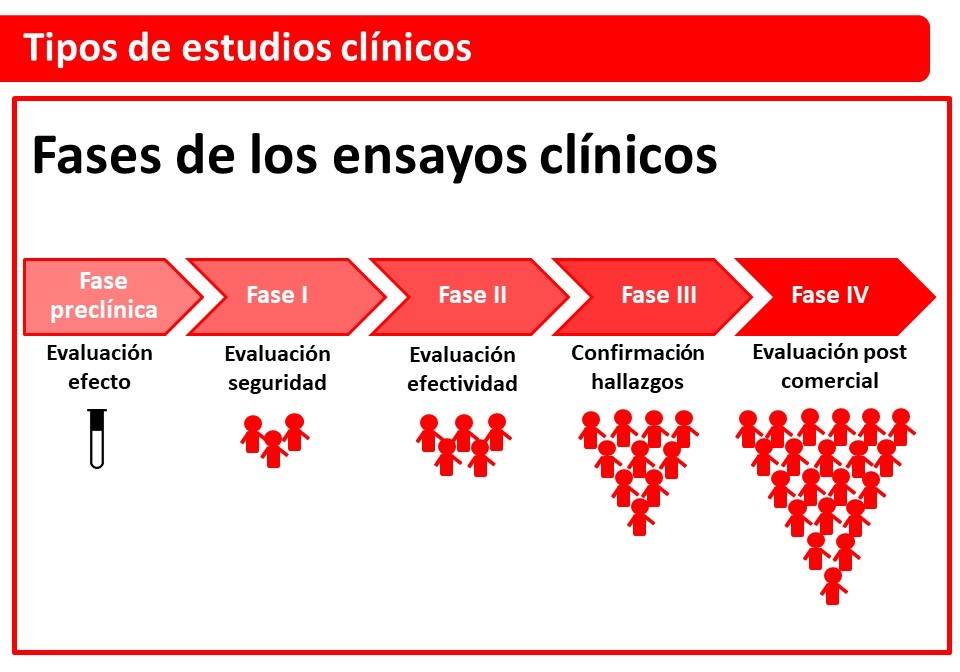
Fases de estudios clínicos
Los ensayos clínicos son fundamentales para que se completen las investigaciones y las distintas agencias como la Food and Drug Administration (FDA) o la European Medicines Agency (EMA) aprueben un cierto tratamiento para su uso en seres humanos. Los ensayos clínicos normalmente se realizan en 3 fases sucesivas.
Los estudios fase 1 evalúan la seguridad del medicamente y buscan determinar la dosis máxima tolerada. Esta es la fase inicial de estudio en humanos y generalmente se realiza en un pequeño número de voluntarios. A veces se testean adultos sanos sin la enfermedad en otras ocasiones se evalúa en pacientes con enfermedades terminales. Por ejemplo, los ensayos fase 1 de seguridad de trasplante de células retínales se realizaron en pacientes ciegos, de manera que no tuvieran riesgo de pérdida de visión.
Los estudios fase 2 se realizan una vez demostrada la seguridad de la droga o medicamento. El objetivo de los estudios fase 2 es evaluar la efectividad del medicamento. La duración del estudio depende del tipo de tratamiento evaluado y la enfermedad en particular. En esta fase participa un mayor número de pacientes, generalmente en distintos lugares o centros.
Los estudios fase 3 permiten calibrar en forma específica la efectividad y los efectos adversos del medicamento en una mayor población de pacientes. Son estudios a mayor escala que entregan una mejor comprensión de la efectividad, los beneficios y los posibles efectos adversos del medicamento. También permiten comparar el tratamiento nuevo con el o los tratamientos estándar.
Si requiere más información sobre ensayos clínicos en curso en IRD´s, visite el sitio https://www.clinicaltrials.gov/